Establishment and validation of a Nomogram predictionmodel for risk of multi-drug resistant infection after operation of cerebral hemorrhage
-
摘要:目的
探讨脑出血术后多重耐药感染的风险因素并构建诺模图预测模型。
方法收集2020年7月—2023年7月本院收治的241例脑出血手术患者的临床资料,并分为感染组和非感染组。采用Logistic回归模型分析脑出血患者术后发生多重耐药感染的独立影响因素,并构建诺模图预测模型。采用一致性指数(C-index)、受试者工作特征(ROC)曲线及校准曲线评价诺模图的预测效能。
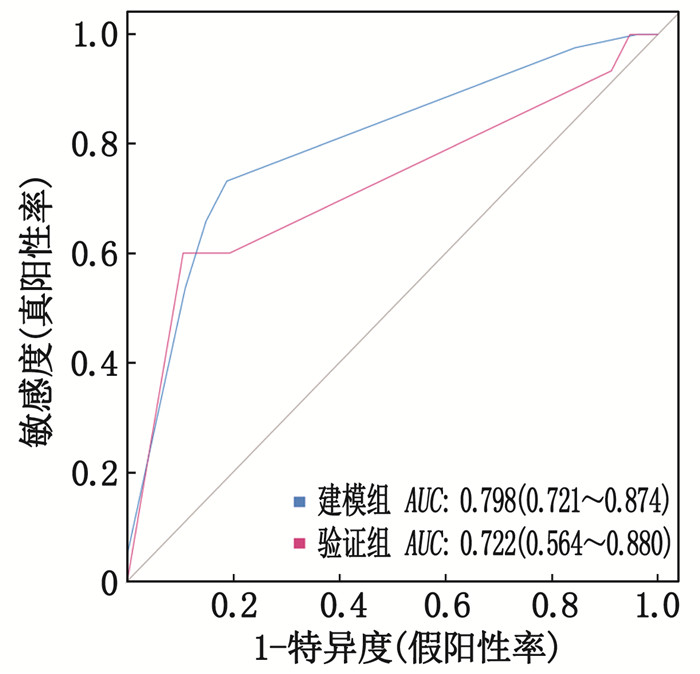
结果本研究共纳入241例脑出血患者,术后发生多重耐药感染56例(23.24%)。感染组术前格拉斯哥昏迷量表(GCS)评分、术前呕吐、术前抗菌药物治疗、留置胃管、气管切开、气管插管比率高于非感染组,差异有统计学意义(P<0.05)。Logistic回归分析显示,术前GCS评分≤8分、术前呕吐、术前抗菌药物治疗、留置胃管、气管切开、气管插管均是脑出血患者术后发生多重耐药感染的独立危险因素(OR>1, P<0.05); 术前GCS评分、术前呕吐、术前抗菌药物治疗、气管切开、气管插管的曲线下面积(AUC)值均>0.700,说明上述指标对于脑出血患者术后发生多重耐药感染具有较好的预测价值。基于以上影响因素建立诺模图风险模型,校准曲线的C-index值为0.798, 说明诺模图模型具备较好的区分度; ROC曲线中建模组和验证组的AUC值分别为0.798和0.722, 说明诺模图模型具有良好的预测能效。
结论基于脑出血患者术后发生多重耐药感染的独立危险因素构建的诺模图预测模型能较好地预测脑出血患者术后发生多重耐药感染的概率。
Abstract:ObjectiveTo investigate the risk factors for postoperative multi-drug resistant infection in patients with cerebral hemorrhage and establish a Nomogram prediction model.
MethodsClinical materials of 241 patients with surgery for cerebral hemorrhage in the hospital from July 2020 to July 2023 were collected, and they were divided into infection group and non-infection group. Logistic regression models were used to analyze independent influencing factors for the occurrence of postoperative multi-drug resistant infection in patients with cerebral hemorrhage, and a Nomogram prediction model was constructed accordingly. The predictive performance of the Nomogram was evaluated by the consistency index (C-index), the receiver operating characteristic (ROC) curve, and the calibration curve.
ResultsA total of 241 patients with cerebral hemorrhage were included in this study, among which 56 cases (24.24%) had postoperative multi-drug resistant infection. In the infection group, the preoperative Glasgow Coma Scale (GCS) score, ratio of preoperative vomiting, ratio of preoperative antibiotic treatment, ratio of gastric tube indwelling, ratio of tracheotomy, and ratio of intubation were significantly higher than those in the non-infection group (P < 0.05). Logistic regression analysis revealed that preoperative GCS score ≤8, preoperative vomiting, preoperative antibiotic treatment, gastric tube indwelling, tracheotomy and intubation were the independent risk factors for postoperative multi-drug resistant infection in patients with cerebral hemorrhage (OR > 1, P < 0.05). Values of area under thecurve (AUC) for preoperative GCS score, preoperative vomiting, preoperative antibiotic treatment, tracheotomy and intubation were all above 0.700, indicating these indicators have good predictive value for the occurrence of postoperative multi-drug resistant infection in such patients. Based on these influencing factors, a Nomogram risk model was established. The C-index value of the calibration curve was 0.798, suggesting the Nomogram model has good discriminatory power. The AUC values for the modeling group and validation group in the ROC curve were 0.798 and 0.722 respectively, indicating that the Nomogram model possesses satisfactory predictive efficacy.
ConclusionNomogram prediction model constructed based on independent risk factors for postoperative multi-drug resistant infection in patients with cerebral hemorrhage can effectively predict the probability of such infections occurring in these patients after surgery.
-
脑出血是一种常见的脑血管疾病, 占全部脑卒中病例的15%~30%, 具有起病急骤、进展快速、发病率高且病情严重等特征[1]。患者发生脑出血后且符合相关手术指证,则需要及时进行手术治疗,以清除颅内血肿,降低颅内压,避免脑疝的发生[2]。脑出血常见于身体机能下降的老年人,因各项器官功能逐渐退化,脑出血老年患者更易出现意识障碍[3]。手术治疗会损害患者机体的防御能力,且因术后需要留置各种管道,易发生再出血、多重耐药感染等并发症,延长患者的住院时间,导致病死率增高[4-5]。本研究分析影响脑出血患者术后发生多重耐药感染的危险因素,并构建预测脑出血患者术后发生多重耐药感染风险的诺模图模型,现将结果报告如下。
1. 资料与方法
1.1 一般资料
本研究为多中心回顾性分析,基于如皋市住院病案填报系统并根据国际疾病分类10(ICD-10)标准检索2020年7月—2023年7月住院治疗的脑出血患者资料。纳入标准: ①住院诊断确诊为脑出血者,符合相关诊断标准[6]; ②年龄≥18岁者; ③临床资料完整者。排除标准: ①有自身免疫性疾病者; ②术前存在感染者; ③术后24 h死亡者。本研究已通过本院伦理委员会审批[院科伦审: (2020)伦审第(0000012)号]。
由经过统一培训的脑血管病专家从病案资料中摘录患者的基本信息,包括性别、年龄、高血压、糖尿病、吸烟史、心脏病史、出血部位、手术类型、术前格拉斯哥昏迷量表(GCS)评分[7]、术前呕吐、术前抗菌药物治疗、输血、留置胃管、意识状态、呼吸机使用、气管切开、气管插管。出血部位的判断以患者病历中头颅CT的结果为主要依据,若无相关记录者,则以头颅MRI结果为依据。
1.2 研究方法
根据术后住院期间发生多重耐药感染情况将患者分为感染组和非感染组,比较2组的性别、年龄、高血压、糖尿病、吸烟史、心脏病史、出血部位等资料。
1.3 统计学分析
采用SPSS 26.0统计学软件检验计量资料的正态性,均呈正态分布,以(x±s)表示,组间比较采用独立样本t检验; 计数资料以[n(%)]表示,组间比较采用χ2检验; 采用Logistic回归模型分析脑出血患者术后多重耐药感染的独立影响因素; 绘制受试者工作特征(ROC)曲线并计算曲线下面积(AUC), 检验上述影响因素预测脑出血患者术后发生多重耐药感染的效能; 将确定的危险因素通过R软件和rms程序包引入变量,建立脑出血患者术后发生多重耐药感染的诺模图模型,采用Bootstrap自抽样法获得校准曲线,计算一致性指数(C-index), 进行一致性验证,绘制ROC曲线并进行区分度验证。
2. 结果
2.1 脑出血患者术后发生多重耐药感染情况
本研究共纳入241例脑出血患者,其中男148例,女93例,平均年龄(63.79±8.25)岁; 术后发生多重耐药感染56例(23.24%), 设为感染组,其余185例(76.76%)未发生多重耐药感染者设为非感染组。
2.2 感染组与非感染组的临床资料比较
2组性别、年龄、高血压、糖尿病、吸烟史、心脏病史、出血部位、手术类型、输血、意识不清、呼吸机使用等比较,差异无统计学意义(P>0.05); 感染组术前GCS评分≤8分、术前呕吐、术前抗菌药物治疗、留置胃管、气管切开、气管插管比率高于非感染组,差异有统计学意义(P < 0.05)。见表 1。
表 1 感染组与非感染组临床资料比较(x±s)[n(%)]因素 分类 感染组(n=56) 非感染组(n=185) t/χ2 P 性别 男 32(57.14) 116(62.70) 0.561 0.454 女 24(42.86) 69(37.30) 年龄/岁 62.85±8.64 63.42±8.09 0.455 0.650 高血压 是 38(67.86) 104(56.22) 2.407 0.121 否 18(32.14) 81(43.78) 糖尿病 是 12(21.43) 37(20.00) 0.054 0.816 否 44(78.57) 148(80.00) 吸烟史 有 13(23.21) 46(24.86) 0.063 0.801 无 43(76.79) 139(75.14) 心脏病史 有 5(8.93) 34(18.38) 2.830 0.093 无 51(91.07) 151(81.62) 出血部位 脑干 4(7.14) 15(8.11) 0.002 0.962 半球 52(92.86) 170(91.89) 手术类型 择期 12(21.43) 38(20.54) 0.021 0.886 急诊 44(78.57) 147(79.46) 术前GCS评分(≤8分) 是 34(60.71) 36(19.46) 35.500 < 0.001 否 22(39.29) 149(80.54) 术前呕吐 有 29(51.79) 20(10.81) 44.557 < 0.001 无 27(48.21) 165(89.19) 术前抗菌药物治疗 有 36(64.29) 28(15.14) 53.245 < 0.001 无 20(35.71) 157(84.86) 输血 有 8(14.29) 24(12.97) 0.064 0.800 无 48(85.71) 161(87.03) 留置胃管 有 41(73.21) 60(32.43) 29.367 < 0.001 无 15(26.79) 125(67.57) 意识不清 是 16(28.57) 55(29.73) 0.028 0.868 否 40(71.43) 130(70.27) 呼吸机使用 有 9(16.07) 38(20.54) 0.546 0.460 无 47(83.93) 147(79.46) 气管切开 是 35(62.50) 34(18.38) 40.955 < 0.001 否 21(37.50) 151(81.62) 气管插管 是 39(69.64) 43(23.24) 41.228 < 0.001 否 17(30.36) 142(76.76) GCS: 格拉斯哥昏迷量表。 2.3 影响脑出血患者术后发生多重耐药感染因素的Logistics回归分析
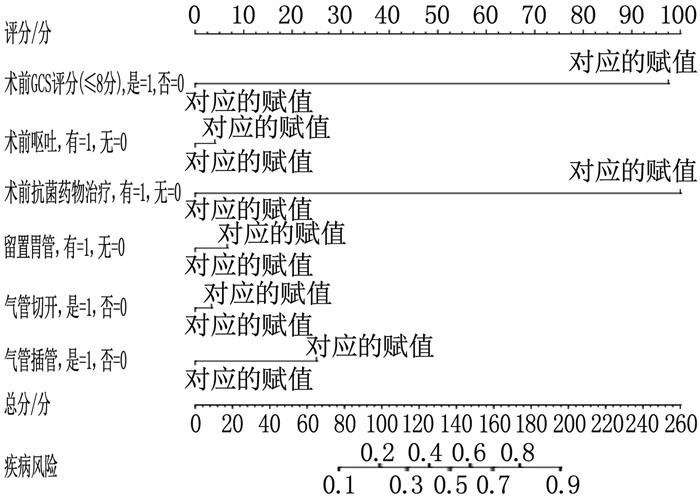
将脑出血患者术后是否发生多重耐药感染作为因变量(感染组=1, 非感染组=0), 将临床资料中有统计学意义的指标(术前GCS评分≤8分、术前呕吐、术前抗菌药物治疗、留置胃管、气管切开、气管插管)作为自变量,变量赋值见表 2。Logistic回归分析显示,术前GCS评分≤8分、术前呕吐、术前抗菌药物治疗、留置胃管、气管切开、气管插管均是脑出血患者术后发生多重耐药感染的独立危险因素(OR>1, P < 0.05), 见表 3。
表 2 变量赋值方式变量 内容 赋值 X1 术前GCS评分(≤8分) 是=1, 否=0 X2 术前呕吐 有=1, 无=0 X3 术前抗菌药物治疗 有=1, 无=0 X4 留置胃管 有=1, 无=0 X5 气管切开 是=1, 否=0 X6 气管插管 是=1, 否=0 Y 术后发生多重耐药感染 是=1, 否=0 表 3 脑出血患者术后发生多重耐药感染因素的Logistics回归分析因素 B 标准误 Wald P OR 95%置信区间 术前GCS评分(≤8分) 1.856 0.331 31.492 < 0.001 6.396 3.345~12.230 术前呕吐 2.182 0.357 37.307 < 0.001 8.861 4.400~17.845 术前抗菌药物治疗 2.312 0.346 44.589 < 0.001 10.093 5.121~19.893 留置胃管 1.739 0.340 26.147 < 0.001 5.694 2.923~11.092 气管切开 2.002 0.335 35.705 < 0.001 7.402 3.839~14.272 气管插管 2.025 0.339 35.730 < 0.001 7.576 3.900~14.716 2.4 影响脑出血患者术后发生多重耐药感染因素的价值
将脑出血患者术后是否发生多重耐药感染作为因变量(感染组=1, 非感染组=0), 将临床资料中有统计学意义的指标(术前GCS评分、术前呕吐、术前抗菌药物治疗、留置胃管、气管切开、气管插管)作为自变量,结果显示术前GCS评分、术前呕吐、术前抗菌药物治疗、留置胃管、气管切开、气管插管的AUC>0.700, 说明上述指标对脑出血患者术后发生多重耐药感染具有较好的预测价值。见表 4。
表 4 影响脑出血患者术后发生多重耐药感染因素的预测价值因素 AUC cut-off值 95%CI P 特异度 敏感度 术前GCS评分(≤8分) 0.706 0.500 0.623~0.789 < 0.001 0.607 0.805 术前呕吐 0.705 0.500 0.619~0.791 < 0.001 0.518 0.812 术前抗菌药物治疗 0.746 0.500 0.665~0.826 < 0.001 0.643 0.849 留置胃管 0.704 0.500 0.626~0.782 < 0.001 0.732 0.676 气管切开 0.721 0.500 0.639~0.802 < 0.001 0.625 0.816 气管插管 0.732 0.500 0.654~0.810 < 0.001 0.696 0.768 2.5 构建预测脑出血患者术后发生多重耐药感染的诺模图模型
根据Logistics回归分析结果构建了影响脑出血患者术后发生多重耐药感染的诺模图模型,将上述危险因素分值相加得到总分并在发生风险数轴上读数,所对应的值即为脑出血患者术后发生多重耐药感染的概率。见图 1。
2.6 预测脑出血患者术后发生多重耐药感染诺模图模型的效应评价
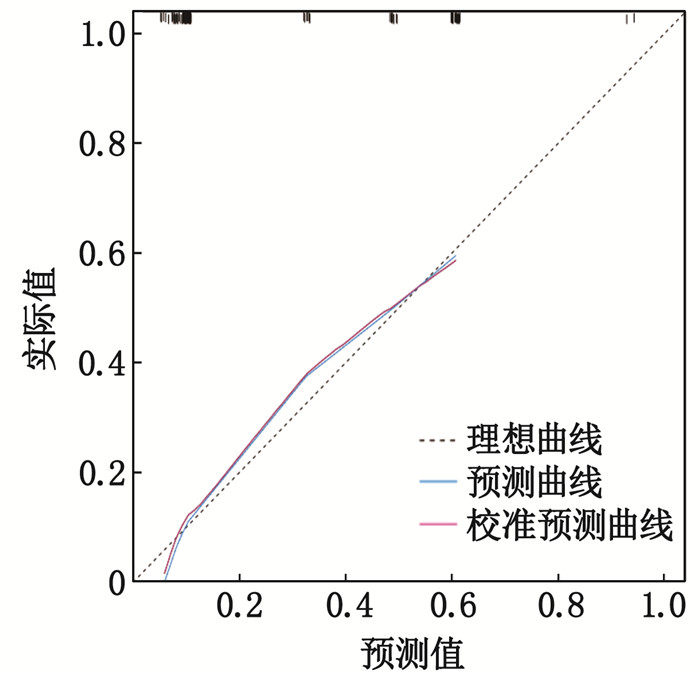
对诺模图模型进行Bootstrap重复抽样1 000次,获得校准曲线,计算的C-index值为0.798, 说明该诺模图模型具备较好的区分度,见图 2。绘制ROC曲线,对脑出血患者术后发生感染的诺模图模型进行评价,建模组的AUC为0.798(95%CI: 0.721~0.874), 验证组的AUC为0.722(95%CI: 0.564~0.880), 区分度较优,说明该诺模图模型预测能效较好,见图 3。
3. 讨论
发生脑出血后,血液会在脑内形成凝血块,从而引发脑血肿,并伴随头痛、呕吐、偏瘫等症状,且临床表现因出血部位不同各存在差异[8]。脑出血发生的早期数小时内病情易恶化,故需要及时进行诊断和处理,首先就是保持患者呼吸道通畅及氧供正常,若患者肺功能指标无法维持正常,则可考虑为脑干病变导致的呼吸中枢受损,或后组颅神经受损引发的呼吸衰竭[9-10]。基于脑出血手术的创伤应激及应用术后免疫抑制剂,脑出血患者术后初期多处于较低的免疫水平,感染是脑出血的主要并发症,其中细菌性感染最为常见,并且以多重耐药菌为其主要的病原体[11]。
本研究241例术后发生多重耐药感染的脑出血患者中,56例存在多重耐药感染,发生率为23.24%。研究[12]指出,多重耐药感染不仅会影响患者临床预后,还会增加患者及医疗机构的经济负担。本研究中,感染组术前用药比率显著高于非感染组,表明术前抗菌药物治疗是导致脑出血患者术后多重耐药感染风险升高的原因,这可能是因抗菌药物在治疗脑出血的同时也影响了机体正常菌群的耐药性,过度使用或滥用抗菌药物易造成抗生素选择性压力,从而引起基因突变及耐药基因转移,增加耐药菌的产生,从而导致术后多重耐药感染[13]。研究[14]认为,术前GCS评分低的患者发生多重耐药感染的概率更大,分析原因为: 脑出血后形成的血肿会压迫临近的神经组织和血管,造成脑组织缺血、缺氧,致使神经组织的能量供给和新陈代谢等受到损害; 同时,血肿及其引起的水肿占位还会引发颅内高压,使患者出现意识障碍, GCS评分下降,患者咳嗽反射以及吞咽功能降低,容易造成误吸、痰液不能及时排出等,而误吸往往会带入条件致病菌进入肺部,此类条件致病菌中存在部分耐药性,容易在体内因转移、整合等形成多重耐药基因,增高术后多重感染的概率[15]。本研究发现,术前呕吐也是术后发生多重耐药感染的独立危险因素,术前呕吐会减弱上呼吸道对空气的过滤和湿化功能,同时降低了纤毛运动对分泌物的清除作用,因此误吸物及条件致病菌更容易进入消化道、口腔,增加感染风险[16]。
气管切开也是造成术后感染的因素之一。脑出血患者术中因呼吸功能差,气道痰液不易排出,术中有需切开气管以改善其呼吸状况[17]; 但气管切开的过程中可能会造成痰液污染与空气感染的交叉感染,条件致病菌也更容易进入气管,造成耐药感染[18]。留置胃管和气管插管也是术后发生多重耐药感染的危险因素,分析原因,留置胃管的患者容易发生胃内容物反流而导致误吸,促使相关病原菌下移,下呼吸道暴露于外界环境中,因而患者更容易发生感染[19]; 气管插管可直接损伤气管黏膜,降低机体防御能力,同时还会在插管过程中将口咽部细菌直接带入气道,促使多重耐药感染率增高[20]。反复吸痰本身也会对气管黏膜及气道防御屏障造成直接损伤,而气管插管则进一步通过改变自然呼吸通道避开了鼻腔黏膜对空气的过滤,从而增加了细菌随呼吸进入肺内的概率,间接损害支气管黏膜,导致机体对条件致病菌的防御性减低[21]。本研究结果还显示,术前GCS评分、术前呕吐、术前抗菌药物治疗、留置胃管、气管切开、气管插管的AUC>0.700, 说明上述指标对脑出血患者术后发生多重耐药感染具有较好的预测价值。基于上述指标构建了预测脑出血患者术后发生多重耐药感染的诺模图模型,验证结果显示其校准曲线C-index为0.798,说明该诺模图模型具备较好的区分度及预测效能。
综上所述,本研究基于术前GCS评分、术前呕吐、术前抗菌药物治疗、留置胃管、气管切开、气管插管构建了脑出血患者术后多重耐药感染的诺模图模型,其能直观地预测脑出血患者术后发生多重耐药感染的概率,具有一定的临床应用价值。
-
表 1 感染组与非感染组临床资料比较(x±s)[n(%)]
因素 分类 感染组(n=56) 非感染组(n=185) t/χ2 P 性别 男 32(57.14) 116(62.70) 0.561 0.454 女 24(42.86) 69(37.30) 年龄/岁 62.85±8.64 63.42±8.09 0.455 0.650 高血压 是 38(67.86) 104(56.22) 2.407 0.121 否 18(32.14) 81(43.78) 糖尿病 是 12(21.43) 37(20.00) 0.054 0.816 否 44(78.57) 148(80.00) 吸烟史 有 13(23.21) 46(24.86) 0.063 0.801 无 43(76.79) 139(75.14) 心脏病史 有 5(8.93) 34(18.38) 2.830 0.093 无 51(91.07) 151(81.62) 出血部位 脑干 4(7.14) 15(8.11) 0.002 0.962 半球 52(92.86) 170(91.89) 手术类型 择期 12(21.43) 38(20.54) 0.021 0.886 急诊 44(78.57) 147(79.46) 术前GCS评分(≤8分) 是 34(60.71) 36(19.46) 35.500 < 0.001 否 22(39.29) 149(80.54) 术前呕吐 有 29(51.79) 20(10.81) 44.557 < 0.001 无 27(48.21) 165(89.19) 术前抗菌药物治疗 有 36(64.29) 28(15.14) 53.245 < 0.001 无 20(35.71) 157(84.86) 输血 有 8(14.29) 24(12.97) 0.064 0.800 无 48(85.71) 161(87.03) 留置胃管 有 41(73.21) 60(32.43) 29.367 < 0.001 无 15(26.79) 125(67.57) 意识不清 是 16(28.57) 55(29.73) 0.028 0.868 否 40(71.43) 130(70.27) 呼吸机使用 有 9(16.07) 38(20.54) 0.546 0.460 无 47(83.93) 147(79.46) 气管切开 是 35(62.50) 34(18.38) 40.955 < 0.001 否 21(37.50) 151(81.62) 气管插管 是 39(69.64) 43(23.24) 41.228 < 0.001 否 17(30.36) 142(76.76) GCS: 格拉斯哥昏迷量表。 表 2 变量赋值方式
变量 内容 赋值 X1 术前GCS评分(≤8分) 是=1, 否=0 X2 术前呕吐 有=1, 无=0 X3 术前抗菌药物治疗 有=1, 无=0 X4 留置胃管 有=1, 无=0 X5 气管切开 是=1, 否=0 X6 气管插管 是=1, 否=0 Y 术后发生多重耐药感染 是=1, 否=0 表 3 脑出血患者术后发生多重耐药感染因素的Logistics回归分析
因素 B 标准误 Wald P OR 95%置信区间 术前GCS评分(≤8分) 1.856 0.331 31.492 < 0.001 6.396 3.345~12.230 术前呕吐 2.182 0.357 37.307 < 0.001 8.861 4.400~17.845 术前抗菌药物治疗 2.312 0.346 44.589 < 0.001 10.093 5.121~19.893 留置胃管 1.739 0.340 26.147 < 0.001 5.694 2.923~11.092 气管切开 2.002 0.335 35.705 < 0.001 7.402 3.839~14.272 气管插管 2.025 0.339 35.730 < 0.001 7.576 3.900~14.716 表 4 影响脑出血患者术后发生多重耐药感染因素的预测价值
因素 AUC cut-off值 95%CI P 特异度 敏感度 术前GCS评分(≤8分) 0.706 0.500 0.623~0.789 < 0.001 0.607 0.805 术前呕吐 0.705 0.500 0.619~0.791 < 0.001 0.518 0.812 术前抗菌药物治疗 0.746 0.500 0.665~0.826 < 0.001 0.643 0.849 留置胃管 0.704 0.500 0.626~0.782 < 0.001 0.732 0.676 气管切开 0.721 0.500 0.639~0.802 < 0.001 0.625 0.816 气管插管 0.732 0.500 0.654~0.810 < 0.001 0.696 0.768 -
[1] O'CARROLL C B, BROWN B L, FREEMAN W D. Intracerebral hemorrhage: a common yet disproportionately deadly stroke subtype[J]. Mayo Clin Proc, 2021, 96(6): 1639-1654. doi: 10.1016/j.mayocp.2020.10.034
[2] IRONSIDE N, CHEN C J, DING D L, et al. Perihematomal edema after spontaneous intracerebral hemorrhage[J]. Stroke, 2019, 50(6): 1626-1633. doi: 10.1161/STROKEAHA.119.024965
[3] SCHRAG M, KIRSHNER H. Management of intracerebral hemorrhage: JACC focus seminar[J]. Am Coll Cardiol, 2020, 75(15): 1819-1831. doi: 10.1016/j.jacc.2019.10.066
[4] D'AMATO S A, CHANG T R. Advances in intracranial hemorrhage: subarachnoid hemorrhage and intracerebral hemorrhage[J]. Crit Care Clin, 2023, 39(1): 71-85. doi: 10.1016/j.ccc.2022.06.003
[5] 周媛媛, 周珏, 许飚, 等. 某中医院重症监护病房医院感染现状及患者预后分析[J]. 实用临床医药杂志, 2023, 27(10): 117-123. doi: 10.7619/jcmp.20223883 [6] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国脑出血诊治指南(2014)[J]. 中华神经科杂志, 2015, 48(6): 435-444. doi: 10.3760/cma.j.issn.1006-7876.2015.06.002 [7] DIKMEN S, MACHAMER J, MANLEY G T, et al. Functional status examination versus Glasgow outcome scale extended as outcome measures in traumatic brain injuries: how do they compare[J]. Neurotrauma, 2019, 36(16): 2423-2429. doi: 10.1089/neu.2018.6198
[8] HOSTETTLER I C, SEIFFGE D J, WERRING D J. Intracerebral hemorrhage: an update on diagnosis and treatment[J]. Expert Rev Neurother, 2019, 19(7): 679-694. doi: 10.1080/14737175.2019.1623671
[9] KASE C S, HANLEY D F. Intracerebral hemorrhage: advances in emergency care[J]. Neurol Clin, 2021, 39(2): 405-418. doi: 10.1016/j.ncl.2021.02.002
[10] DE OLIVEIRA MANOEL A L. Surgery for spontaneous intracerebral hemorrhage[J]. Crit Care, 2020, 24(1): 45. doi: 10.1186/s13054-020-2749-2
[11] BUKOWSKI K, KCIUK M, KONTEK R. Mechanisms of multidrug resistance in cancer chemotherapy[J]. Int Mol Sci, 2020, 21(9): 3233. doi: 10.3390/ijms21093233
[12] 王丹, 朱丹, 邹妮. 多重耐药菌医院感染的经济负担研究进展[J]. 老年医学与保健, 2021, 27(2): 417-419. doi: 10.3969/j.issn.1008-8296.2021.02.052 [13] MOISEEVA N I, LALETINA L A, FETISOV T I, et al. Analysis of multiple drug resistance mechanism in different types of soft tissue sarcomas: assessment of the expression of ABC-transporters, MVP, YB-1, and analysis of their correlation with chemosensitivity of cancer cells[J]. Int Mol Sci, 2022, 23(6): 3183. doi: 10.3390/ijms23063183
[14] CHEN S P, LI L Z, PENG C, et al. Targeting oxidative stress and inflammatory response for blood-brain barrier protection in intracerebral hemorrhage[J]. Antioxid Redox Signal, 2022, 37(1/2/3): 115-134.
[15] RHIM H Y, WON S Y, KASHEFIOLASL S, et al. Multidrug-resistant organisms (MDROs) in patients with subarachnoid hemorrhage (SAH)[J]. Sci Rep, 2021, 11(1): 8309. doi: 10.1038/s41598-021-87863-y
[16] MAGID-BERNSTEIN J, GIRARD R, POLSTER S, et al. Cerebral hemorrhage: pathophysiology, treatment, and future directions[J]. Circ Res, 2022, 130(8): 1204-1229. doi: 10.1161/CIRCRESAHA.121.319949
[17] DING W L, XIANG Y S, LIAO C, et al. Early tracheostomy is associated with better prognosis in patients with brainstem hemorrhage[J]. Integr Neurosci, 2020, 19(3): 437-442. doi: 10.31083/j.jin.2020.03.25
[18] LUO B, CHEN H X, SONG X D, et al. Timing of tracheostomy in patients with intracerebral haemorrhage: a propensity-matched analysis[J]. Curr Neurovasc Res, 2022, 19(3): 367-377. doi: 10.2174/1567202619666220920122935
[19] YANG H J, FAN Y S, LI C H, et al. A retrospective study on risk factors and disease burden for hospital-acquired pneumonia caused by multi-drug-resistant bacteria in patients with intracranial cerebral hemorrhage[J]. Neurol Sci, 2022, 43(4): 2461-2467. doi: 10.1007/s10072-021-05721-1
[20] 刘超, 杨昱琦, 耿文, 等. 定期变换气管插管套囊位置对减少气道黏膜损伤的应用研究[J]. 护士进修杂志, 2020, 35(9): 853-855. https://www.cnki.com.cn/Article/CJFDTOTAL-FSJX202009027.htm [21] YIN B, LI W H, YU H, et al. Study of adverse events of endotracheal intubation[J]. Zhongguo Yi Liao Qi Xie Za Zhi, 2021, 45(6): 692-697.
-
期刊类型引用(3)
1. 李梦瑶,卢光玉,施楠,曾庆平,高先茹,李育平. 耐甲氧西林金黄色葡萄球菌感染风险预测模型的系统评价. 实用临床医药杂志. 2024(12): 118-124 .  本站查看
本站查看
2. 胡晔,尹存林,吴慧,张琳琳,王红霞,黄磊. 老年患者腹腔镜胆囊切除术后感染的影响因素分析和列线图模型建立. 中国临床药学杂志. 2024(05): 334-338 .  百度学术
百度学术
3. 王亚娟,谭薇,李玉萌,张桂佳. 社区老年人脑卒中与肌肉减少症相关性研究进展. 深圳中西医结合杂志. 2024(15): 132-136 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号